Antiguamente, para producir el color oscuro de la fumata se usaba brea o ‘negro de humo’ mientras se quemaban las papeletas en una estufa. Y para el color blanco se utilizaba paja, aunque hay versiones contradictorias sobre si estaba seca o húmeda.
Pero debido a varias ocasiones donde la fumata salió gris y confundió a los espectadores, los responsables del Vaticano decidieron pedir ayuda a la química y a la tecnología.
 El humo negro que ha salido este martes y en la mañana del miercoles del tejado de la Capilla Sixtina se produce con tres compuestos fumígenos: azufre, perclorato de potasio y antraceno. Es la mezcla con la que se han generado las dos fumatas negras del cónclave que se ha desarrollado esta semana en Roma.
El humo negro que ha salido este martes y en la mañana del miercoles del tejado de la Capilla Sixtina se produce con tres compuestos fumígenos: azufre, perclorato de potasio y antraceno. Es la mezcla con la que se han generado las dos fumatas negras del cónclave que se ha desarrollado esta semana en Roma.
El antraceno es, a temperatura ambiente, una sustancia incolora de naturaleza aromática, aunque al quemarse en condiciones con poco oxígeno genera también negro de humo.
En las fumatas negras se produce una combustión incompleta donde, aunque también se genera vapor de agua, aparece monóxido de carbono (CO) y negro de humo u hollín, un polvo muy fino que al ser arrastrado hace que el humo se vea negro. Se conoce como negro de humo al material que se produce cuando un combustible carbonado
se quema con escasez de aire, de negro de humo está compuesto el típico ahumado
que se produce en las lámparas de combustión cuando la llama tiene un tamaño excesivo
y la afluencia de aire no es suficiente.
La combustión se considera incompleta cuando parte del combustible no reacciona completamente porque el oxígeno no es suficiente. Cuando una sustancia orgánica reacciona con el oxígeno de manera incompleta forma además de dióxido de carbono (CO2) y agua (H2O) otros subproductos, como Carbono (C) y monóxido de carbono (CO). En altas concentraciones los resultados de la combustión pueden ser letales
Así, por ejemplo, el benceno arde fácilmente con llama amarillenta y fuliginosa (que humea), debido a la gran masa de carbono que queda sin quemar.
La ecuación que representa la combustión incompleta es:
C6H6 + O2 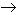 CO2 + CO + H2O + C
CO2 + CO + H2O + C
Si en cambio, la reacción sería completa, se reemplazaría la ecuación anterior por:
C6H6 + O2 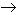 CO2 + H2O
CO2 + H2O
Para que se entienda mejor, vamos a ver el ensayo a la llama o de Beilstein: Se pone una pequeña cantidad de sustancia en una espátula de porcelana o de acero inoxidable y se mantiene directamente sobre la llama de un mechero Bunsen. Si el material es una sustancia orgánica arderá. Si el material es una sal que aparece como subproducto de una reacción, no arderá y puede desecharse sin más.
Cuando el material arde surge la pregunta: ¿Puede sacarse alguna conclusión de la observación de la llama?. La respuesta es un sí rotundo. Si el material arde limpiamente con una llama azul sin humo puede suponerse que la relación carbono/hidrógeno será generalmente baja, ya que probablemente la sustancia contiene oxígeno que activa la combustión de la misma. Cuanto menor sea la relación carbono/hidrógeno, más caliente y azulada será la llama. Si la relación carbono/hidrógeno está cercana a 1, como en el benceno, el compuesto arderá con una llama fuliginosa indicativa de combustión incompleta. Los compuestos aromáticos arden generalmente con una llama fuliginosa amarilla. Además, puede quedar ceniza o residuo. La presencia de ceniza es también característica de una combustión incompleta o de un elemento inorgánico.
Así, por ejemplo:
el heptano CH3-CH2-CH2-CH2-CH2-CH2-CH3 con C/H=0,44, arde con llama azul limpia
el benceno C6H6 con C/H=1,00 arde con llama amarilla fuliginosa
el antraceno C14H10 con C/H=1,4
Por su parte, el azufre es un agente ‘entrecruzante’ de la materia carbonosa, así que se usa porque ayuda a que la mezcla se queme peor. El azufre es un material con singulares propiedades. En determinadas circunstancias, forma cadenas de sus propios átomos. El carbono y el silicio pueden formar también esas cadenas.
El azufre al reaccionar con las moléculas orgánicas forma una red tridimensional entre los segmentos de la cadena formando enlaces C-C, C-S-C y C-Sx-C, a todo este proceso se le conoce como vulcanización, curado, entrecruzamiento o reticulación.
El azufre al reaccionar con las moléculas orgánicas forma una red tridimensional entre los segmentos de la cadena formando enlaces C-C, C-S-C y C-Sx-C, a todo este proceso se le conoce como vulcanización, curado, entrecruzamiento o reticulación.
En general, los entrecruzantes que más se utilizan son los que se usan para generar enlaces cruzados, produciendo un polímero entrecruzado, termoestable a partir de un polímero inicialmente lineal o ramificado En este caso, las cadenas de polímero se unen químicamente una con otra en varios puntos a lo largo de su molécula.
El ejemplo clásico es el proceso de vulcanización del caucho, que hace uso de este fenómeno. A lo largo de la molécula del caucho, hay un número de sitios que son atractivos para los átomos de azufre. Son los llamados sitios de cura. En cada sitio de cura, un átomo de azufre se puede unir a sí mismo, y a partir de allí la cadena de átomos de azufre puede crecer hasta que alcance el sitio de cura de otra molécula. Estos puentes de azufre son usualmente de 2 a 10 átomos de largo, en contraste con los polímeros más comunes en los que la «columna vertebral» de carbonos puedes ser varios miles de veces de larga.
Y respecto al clorato y el perclorato, son muy parecidos: los dos son oxidantes, ayudan a que no se detenga la combustión y aportan oxígeno extra. En la fumata negra se utiliza una proporción baja de perclorato, lo suficiente para asegurarse que no se detenga la combustión y no se acabe antes de tiempo.
La diferencia consiste en que como un oxidante, el perclorato de potasio puede ser usado de manera segura en la presencia de azufre, mientras que el clorato de potasio no puede. La mayor reactividad del clorato es típica, ya que los percloratos son cinéticamente oxidantes más pobres. El clorato produce ácido clórico (HClO3), que es altamente inestable y puede llevar a una ignición prematura de la composición. En cambio, el ácido perclórico es bastante estable.
Para producir las fumatas blancas, se usa lactosa, clorato de potasio y colofonia. Esta última, conocida como ‘pez de Castilla’, es la resina ámbar de los pinos y otras coníferas.
La lactosa es un azúcar que se quema muy bien, y la colofonia, una resina, también arde de maravilla en exceso de oxígeno. En estas condiciones, la combustión completa de la materia orgánica da solo CO2 y vapor de agua, que es el que hace que el humo se vea blanco. Y así, Habemus Papam.
+23.18.39.png)




Interesante! Cuando salió el tema del Papa me preguntaba yo qué mezclas usaban para obtener un humo negro negro y el humo blanco blanco, sin ambigüedad. Me alegra ver que no andaba desencaminado en mis hipótesis, aunque no tenía ni idea de que compuestos concretos usarían. Me ha sorprendido lo de la colofonia. Gracias por contarlo. Por cierto, por "resina ámbar" te refieres al color ámbar, no al ámbar en si mismo, que es la resina una vez fosilizada...
ResponderEliminarHe leído varios artículos sobre las fumatas, y aunque citaban los componentes, no daban la función de los mismos. Yo he deducido que son éstas, pero modificarlo/corregirlo si acaso no he estado acertado. En la colofonia me refería al color clásico que se le otorga al ámbar, aunque en realidad, puede presentar varios colores. Acabo de leer tu post sobre la compra del oro, y me gusta mucho la vertiente pedagógica y de utilidad que le das. Un saludo
Eliminar